PBMC/全血/粒细胞全覆盖:CRS检测的终极方案
2025.10.21
CRS检测的终极方案
前言
CRS检测在临床前成药性评价中的应用
1、抗体类药物药效评估
双特异性抗体(BiTE):如TCE分子,通过检测效应细胞(如CD8+ T细胞)释放的IL-2、IFN-γ等细胞因子的浓度变化,验证药物对T细胞的激活能力。例如,贝林妥欧单抗(CD3/CD19双抗)的体外实验中,IL-2和IFN-γ水平呈剂量依赖性上调,直接反映其免疫激活效果。
抗体偶联药物(ADC):通过分析DAMPs(如HMGB1)及促炎细胞因子(IL-1β、IL-6)释放,评估ADC诱导的免疫原性细胞死亡(ICD)效应。
2、安全性风险预测
单抗、多抗、细胞治疗类药物可能引发细胞因子释放综合征(CRS),体外细胞因子释放实验(CRA)可早期识别高风险药物。例如,通过PBMC或者全血与待测药物共孵育检测上清中IL-1β、IL-2、IL-6、TNF-α等多种因子水平,反映潜在的临床安全风险。
3、细胞治疗产品优化
异体细胞疗法中,细胞因子释放实验(如IL-6、IL-8)可预测临床CRS风险,并指导异体回输治疗方案的优化,如敲除关键细胞表面抗原、调整抗GVHD药物剂量、用药时机等降低CRS风险。
赛笠百傲依据自身平台优势,可提供基于全血、PBMC、粒细胞、单核细胞等多种样本类型,CBA、Elisa等多种检测方法的定制化因子检测平台,单次可检测多种生物标志物,拥有超高灵敏度,适配微量样本,助力加速药物研发进程。
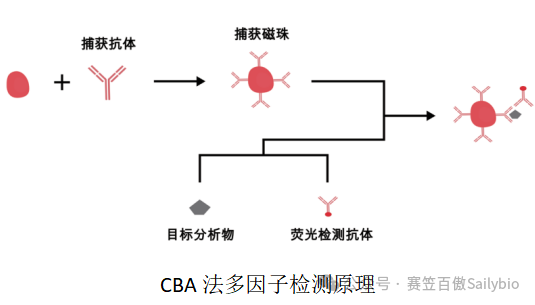
-
提供从样本采集、分选到数据交付的一体化服务。
-
拥有丰富的donor库,可预筛阳性对照效果好的批次。
-
拥有PBMC、全血、粒细胞等多种样本类型供选择。
-
已分选好多种免疫细胞亚型,快速响应满足不同研究的需求。
-
有成熟的固相和液相检测体系可供客户选择。
-
可满足新药申报合规性文件要求。
部分项目数据展示:
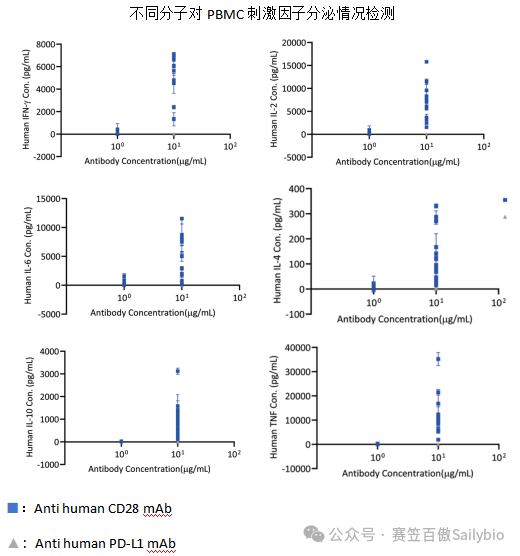
.png)
.jpg)